“RESERPINE”
Reserpin adalah alkaloid
indole yang diisolasi pada tahun 1952 dari ekstrak Rauwolfia sepentina atau 'akar ular India', tanaman populer dalam
pengobatan tradisional India yang digunakan sebagai obat penenang dan
antipiretik. Ini juga
mendapat perhatian dari dokter Barat sebagai antihipertensi dan antipsikotik,
terutama menjadi obat pertama yang berhasil menunjukkan sifat antidepresan
dalam uji coba terkontrol plasebo secara acak.
Reserpin
merupakan obat antihipertensi yang bekerja dengan mendeplesi simpanan
katekolamin dan 5-hidroksitriptamin pada berbagai organ, seperti otak dan
medula adrenal. Sebagian efek farmakologiknya disebabkan mekanisme ini. Efek
sedatif dan penenang akibat reserpin diduga berhubungan dengan proses deplesi
dalam otak.
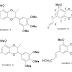
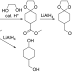
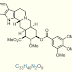
Struktur resepin yakni:
Analisis retrosintesis dari reserpine
yakni:
Tantangan sintetis reserpin diposisikan oleh sistem
cincin D / E pada Inti pentaklik
Strategi sintetis mengharuskan persiapan pada Turunan
hydroisoquinoline yang kemudian dapat dimodifikasi untuk menyediakan Sistem
cincin D / E
Prior
Work- Reaksi Diels-Alder
• Pembuatan sistem
hidroisoquinoline tersubstitusi dimungkinkan Karena sebelumnya dikembangkan
metodologi yang menampilkan intramolekuler Reaksi Diels-Alder menggunakan
aza-trienes
Transformasi terjadi dengan
thermolisis pada suhu 300 ° C dalam wadah tertutup
SINTESIS
RESERPIN
Sintesis reserpine pertama kali diperkenalkan oleh Woodward. Sintesis Woodward dimulai
dengan sintesis diena atau dikenal dengan reaksi Diels-Alder. Di sini, benzoquinon digunakan sebagai dienofil, dan
asam vinilakrilat disiapkan sebagai diena, dan reaksinya dilakukan dalam skala
besar. yakni:
"Kondensasi asam
malonat dengan akrolein dilakukan dalam tiga batch terpisah yang identik. Pada
masing-masing, 2000 g asam malonat ditambahkan ke 4,5 l. Piridin (teknis,
mengandung 0,5 persen air) dengan pengadukan yang kuat. Setelah sekitar 30
menit bagian utama asam malonat telah larut. Campuran kemudian didinginkan
sampai 10º dalam bak mandi dingin, dan 1333 g acrolein ditambahkan sedemikian
rupa sehingga suhu tidak melebihi 12º. Penambahannya selesai sekitar 90 menit;
Pengadukan kemudian dilanjutkan selama 3 jam pada suhu 0º dan kemudian selama
35-40º. (Campuran reaksi sangat kental pada 0ºC dan menjadi cukup bergerak pada
35-40º). Pada akhir periode pengadukan, ketiga batch digabungkan dan
ditambahkan perlahan ke 13 l. Dari larutan asam sulfat 50 persen (v / v) pada
-5º, dengan pengadukan, dan pada tingkat yang sedemikian rupa sehingga suhu
tidak melebihi 15-20º. Campuran tersebut, yang bersifat asam sampai Kongo,
disaring melalui celite. Filtrat kuning jernih diekstraksi enam kali dengan eter
(tiga kali dengan 7 gal dan tiga kali masing-masing 3 gal ). Ekstrak eter dua
kali dicuci dengan air, dikeringkan dengan natrium sulfat anhidrat, dan
dipekatkan ke 3 gal. Enam galon benzena kemudian ditambahkan, dan campuran itu
kembali terkonsentrasi pada 3 galon.
Tiga setengah kilogram
quinone (Eastman Kodak Practical, direkristalisasi dengan ekstraksi Soxhlet
dengan oktan, jika kristal besar quinone terbentuk, bahan harus digiling
sebelum digunakan), dilarutkan dalam 2 galon benzena, ditambahkan ke benzena di
atas. Larutan asam vinylacrylic. Campuran dipanaskan dengan refluks selama 3
jam, kemudian disaring panas (sekitar 45-50º). Hasil saringan terdiri dari 2,3 kg
aditif kasar abu-abu ... "
Metode tersebut merupakan
langkah-langkah dalam sintesis reserpine.
Meskipun hasil untuk reaksi
Diels-Alder sangat buruk (karena tautomerisasi / aromatisasi reaktan awal yang
tidak dapat dipulihkan), lebih dari 2 kg produk olahan murni diperoleh dari
langkah tersebut, memberikan banyak bahan untuk penyelidikan langkah
selanjutnya. Produk dari reaksi ini memberikan titik awal yang bagus untuk
sintesis; Ini berisi cincin E reserpin dengan tiga dari lima pusat stereogenik
bersebelahan, serta sebuah gugus karboksil ditempatkan 'secara felicitously'
dan 'ikatan rangkap augury yang bagus untuk pengenalan atom oksigen pada posisi
yang sesuai' . Selanjutnya, diferensiasi kedua kelompok karbonil dibutuhkan. Perlakuan
garam natrium dari adisi Diels-Alder dengan sodium borohidrida memberikan
kesempatan seperti itu, menyelesaikan reduksi selektif dari karbonil jauh dari
karboksilat. Epoksidasi dengan asam perbenzoat terjadi pada ikatan rangkap yang
kaya elektron lebih banyak (dari muka cembung), dan ini segera diikuti oleh
laktonisasi, yang dilakukan dengan pengobatan dengan anhidrida asetat.
Menariknya, jika urutan
kedua langkah ini dibalik, tidak ada produk yang diperoleh pada tahap
epoksidasi. Pengurangan Meerwein-Ponndorf-Verley dengan perlakuan dengan
triisoproksida aluminium dalam isopropanol kemudian menyebabkan urutan reaksi
yang luar biasa terjadi di tempat, termasuk pengurangan keton,
transesterifikasi untuk memberi lactone beranggota 5, pembukaan epoksida oleh
alkohol allylic yang baru dibebaskan, Dan akhirnya penghilangan air. Ester α,
β-tak jenuh yang dihasilkan dari urutan ini kemudian diolah dengan sodium
methoxide untuk menghasilkan produk tambahan konjugasi dengan hasil yang sangat
baik mengingat apa yang telah dicapai.
Sama mengesankannya dengan
pesatnya perkembangan tetracycle stereokimia dengan serangkaian pereaksi
sederhana, Woodward belum mempertimbangkan masalah ini untuk memecahkannya, dan
bahkan mempublikasikan rute yang lebih pendek lagi ke perantara yang sama.
Dengan menggunakan
pengetahuan yang didapat dari penelitian sebelumnya, urutan enam langkah di
atas disingkat menjadi hanya empat langkah. Rute baru dimulai dengan versi
modifikasi dari reaksi Diels-Alder sebelumnya, yang menggunakan metil
vinilakrilat sebagai pengganti asam vinilakrilat. Reaksi ini sayangnya jauh
lebih rendah daripada yang sebelumnya digunakan, memberikan hasil yang
diinginkan hanya pada hasil 8%, walaupun langkah ini tidak banyak dioptimalkan.
Secara teori, ester ini juga
bisa diperoleh dengan esterifikasi aditif Diels-Alder sebelumnya. Namun, hanya
hasil yang sangat rendah yang diperoleh untuk langkah ini karena aromatisasi
(dalam kondisi asam) atau reaksi samping pada olefin (dengan diazometana).
Ester sekarang terpapar pada kondisi Meerwein-Ponndorf-Verley yang sama seperti
sebelumnya, yang mengurangi kedua gugus karbonil dan juga menyebabkan
terbentuknya lakton antara ester dan alkohol terdekat. Perlakuan terhadap
lactone trisiklik ini dengan bromin dalam metanol kemudian dilakukan dengan
bromoisiifikasi alkohol yang tersisa. Sekali lagi, kedua reaksi terjadi dari
wajah cembung sistem cincin dengan stereokontrol yang pada dasarnya sempurna.
Akhirnya, atom bromin dipindahkan oleh metoksida, dengan retensi stereokimia,
yang mungkin terjadi pertama kali oleh hilangnya bromida melalui proses E1cB,
dilanjutkan dengan penambahan metanol dari konjugasi.
Woodward menganggap sintesis
reserpin sebagai masalah stereokimia, dan inilah solusi yang hampir sempurna mensintesisnya
hanya dalam empat langkah, semua lima sterocentres bersebelahan di seputar
cincin E. Meskipun beberapa hasil yang agak rendah, puluhan gram zat antara
tetrasiklin yang dibutuhkan masih dapat diperoleh dengan menggunakan langkah
ini.

Sebenarnya, setelah diamati
lebih dekat, tetrasikam ini bukanlah zat antara sempurna, karena mengandung
karboklik, cincin THF dan lakton yang tidak diinginkan, serta beberapa pusat
stereogenik tambahan, dan Woodward sekarang mulai memangkasnya sampai ukuran
yang diinginkan. Proses ini dimulai dengan pembentukan bromohidrin pada sisa
olefin, dengan pembentukan bromonium diikuti pembukaan regioselektif oleh air,
yang mungkin dibantu oleh ikatan hidrogen dengan oksigen laktone di dekatnya.
Oksidasi gugus hidroksil bromohidrin memberikan α-bromoketon, yang mengalami
urutan kaskade mengesankan lainnya pada perlakuan dengan seng dalam asam
asetat, menghasilkan cincin tetrahidrofuran dan lakton yang dibuka. Esterifikasi
asam dibebaskan dengan diazometana dan perlindungan asetat dari hidroksil yang
dibebaskan kemudian memberikan enone bicyclic, hanya dengan lima stereokonson
E-ring yang tersisa. Sistem decalin yang kaku sekarang telah melampaui
kegunaannya, dengan mengagumkan telah melakukan perannya dalam membimbing
oksigenasi stereoselektif di sekitar molekul. Jadi, sikloheksenon yang tidak
diinginkan dihilangkan dengan dihidroksilasi pertama dengan osmium tetroksida,
diikuti oleh pembelahan oksidatif (dengan hilangnya satu karbon) ke asam
aldehid, yang diubah menjadi metil ester yang sesuai dengan pengobatan dengan
diazometana.

Dengan keseluruhan E-ring
dengan lima stereocentres bersebelahan yang disintesis, meskipun dalam bentuk
rasemat, hanya satu stereocentre yang tetap harus ditetapkan, dan ini harus
dilakukan pada tahap pembentukan tetrahydrocarboline. Jadi, 6-methoxytryptamine
dikondensasikan dengan aldehid E-ring dan iminium yang dihasilkan kemudian
dikurangi dengan natrium borohidrida untuk menghasilkan amina sekunder yang
secara spontan dikencangkan ke ester terdekat untuk membentuk laktam. Bila
laktam ini dipanaskan dengan kelebihan fosfor oksida fosfor yang sehat, ia
menjalani siklisasi Bischler-Napieralski dengan indol untuk membentuk
dihydro-β-carboline yang segera dikurangi dengan sodium borohidrida sebelum
bisa terbentuk. Sayangnya, meskipun hasil dari dua tahap ini bagus, ditemukan
bahwa dalam reduksi bahwa hidrida telah ditambahkan ke sisi yang salah dari ion
iminium, memberikan hanya diastereomer produk yang tidak diinginkan.

Epimerisasi stereosfer
tampak agak tidak reaktif ini, dengan adanya semua fungsi lain dalam molekul,
adalah prospek yang menakutkan, yang kemudian diperumit oleh fakta bahwa produk
yang dihasilkan tampak sebagai produk termodinamika. Meskipun hasil ini tampak
malang pada tahap ini dalam kampanye, Woodward beralasan bahwa jika konformasi
cincin D dan E dapat diubah maka preferensi termodinamika pusat yang bermasalah
juga dapat berubah, membuat epimerisasi mungkin terjadi. Dengan pemikiran ini,
cincin ekstra dimasukkan ke dalam sistem oleh hidrolisis kelompok pelindung
asetat dan metil ester, dilanjutkan dengan pembentukan lakton transannular
melintasi cincin E. Hebatnya, ini memiliki efek dramatis untuk memaksa cincin C
dan D menjadi konformasi yang sekarang memungkinkan epimerisasi asam-katalisator
stereosenis terakhir.

Dengan ini sekarang
ditetapkan dengan konfigurasi yang benar, lakton sementara sekarang
dihidrolisis, dan ester trimetoksibenzoat yang ditemukan pada produk alami
terbentuk, menghasilkan reserpin rasiat. Akhirnya, resolusi dengan asam
D-camphorsulfonic memberi enantiomer tunggal dari produk alam.
Serangkaian proses tersebut
akan menghasilkan produk reserpine.
DAFTAR
PUSTAKA
R. B. Woodward, F. E. Bader,
H. Bickel, A. J. Frey, R. W. Kierstead. 1956. THE TOTAL SYNTHESIS OF RESERPINE. J. Am. Chem. Soc.78 (9) : 2023–2025.
R. B. Woodward, F. E. Bader,
H. Bickel, A. J. Frey, R. W. Kierstead. 1956. A SIMPLIFIED ROUTE TO A KEY
INTERMEDIATE IN THE TOTAL SYNTHESIS OF RESERPINE. J. Am. Chem. Soc. 78 (11). : 2657–2657
R.B. Woodward. H. Bickel.,
A.J. Frey., R.W. Kierstead. 1958. The total synthesis of reserpine. Tetrahedron. Volume 2, Issues 1–2, 1958,
Pages 1-57.
Stephen F. Martin, Sidney A.
Williamson, R. P. Gist, and Karl M. Smith, J. Org. Chem., 1983, 48, 5170-5180.